2019年5月1日至2020年4月30日期间��
,20名结核病患者入住ICU并参加了该研究��
。中位数年龄和体重分别为35.5岁和63公斤(表1)��
。所有患者均经微生物学证实患有结核病��
,40% 的患者同时感染艾滋病毒��
。在结核病/艾滋病毒合并感染的患者中�
,分化簇 4 计数中位数为 123个细胞/mm3��
,并且只有一名患者正在接受抗逆转录病毒治疗��
。所有患者因难治性低氧血症均需有创机械通气�
,且无鼻胃管肠内喂养禁忌症��
。患者在第一次采样前接受了 2 天的治疗��
,并接受每日 9.5 mg/kg (9.1-10.3) 剂量的利福平��
。
禁食状态下的中位 Cmax为5.1 μg/ml��
,进食状态下为3.3 μg/ml(P <0.0001)(表 2)��
。序列A(进食→禁食)中禁食状态的中位Cmax为5.5μg/ml�
,序列B(禁食→进食)为4.7μg/ml��
;而序列A(进食→禁食)中进食状态的中位Cmax为3.1μg/ml�
,序列B(禁食→进食)为3.4 μg/ml(图S1)��
。80%的禁食状态患者和所有进食状态患者的利福平Cmax低于建议的目标阈值�
。禁食状态下的 Cmax 相对于进食状态下的几何平均比率为1.95(90% 置信区间 [CI] 1.46-2.60)�
。
禁食状态下利福平 AUC0-8 中位数为 27.4 mg·h·l-1��
,进食状态下为 18.7 mg·h·l-1(P值 = 0.0003)(表2)��
。禁食状态下的中位 AUC0-8在序列A(进食→禁食)中为 27.4 mg·h·l-1��
,在序列B(禁食→进食)中为 28 mg·h·l-1��
,而序列A(进食→禁食)中进食状态下的中位 AUC0-8为16.7 mg·h·l-1��
,序列 B(禁食→进食)中为 23.5 mg·h·l-1(图 S1)��。75%的禁食状态患者和85%的进食状态患者中利福平AUC0-8低于建议的目标阈值 (41 mg·h·l-1)��
。禁食状态下AUC0-8相对于进食状态下的几何平均比率为1.94 (90% CI 13.5-2.78)��
。
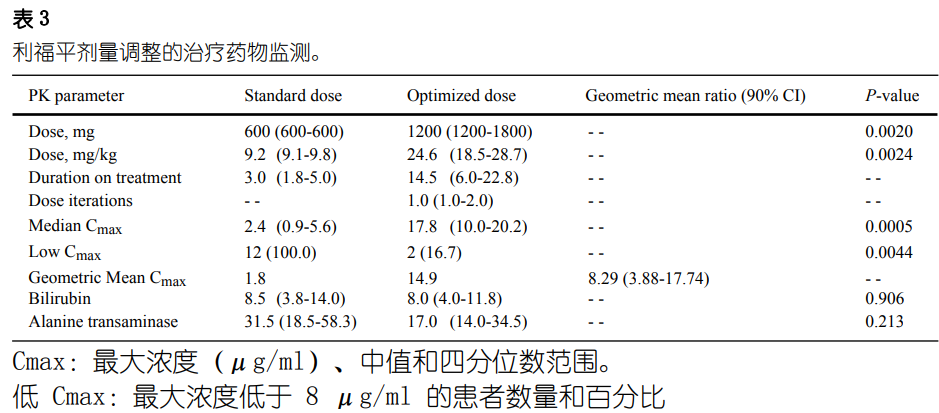
在该研究的 TDM 部分(由 12 名参与者组成)中��
,剂量重复递增至最大40 mg/kg(图 S2)��
。利福平的中位优化剂量为 1200 mg(24.6 mg/kg�
,表3)��
。使用标准剂量利福平时��
,没有任何患者 (0/12) 达到目标药物浓度��,而83% (10/12) 的患者在剂量递增后达到目标药物浓度 (p = 0.0044)�
。七名��
、一名和两名参与者分别在一次��
、两次和三次剂量重复后达到了目标药物浓度(图 S3)��
。两名未达到利福平暴露目标的患者分别升级至 1200 mg(20 mg/kg)和 1800 mg(30 mg/kg)��
,但在进一步剂量升级之前死于难治性低氧血症��
。没有观察到与治疗相关的不良事件��
。具体来说��
,没有遇到2级或更高级别的丙氨酸转氨酶或胆红素异常��
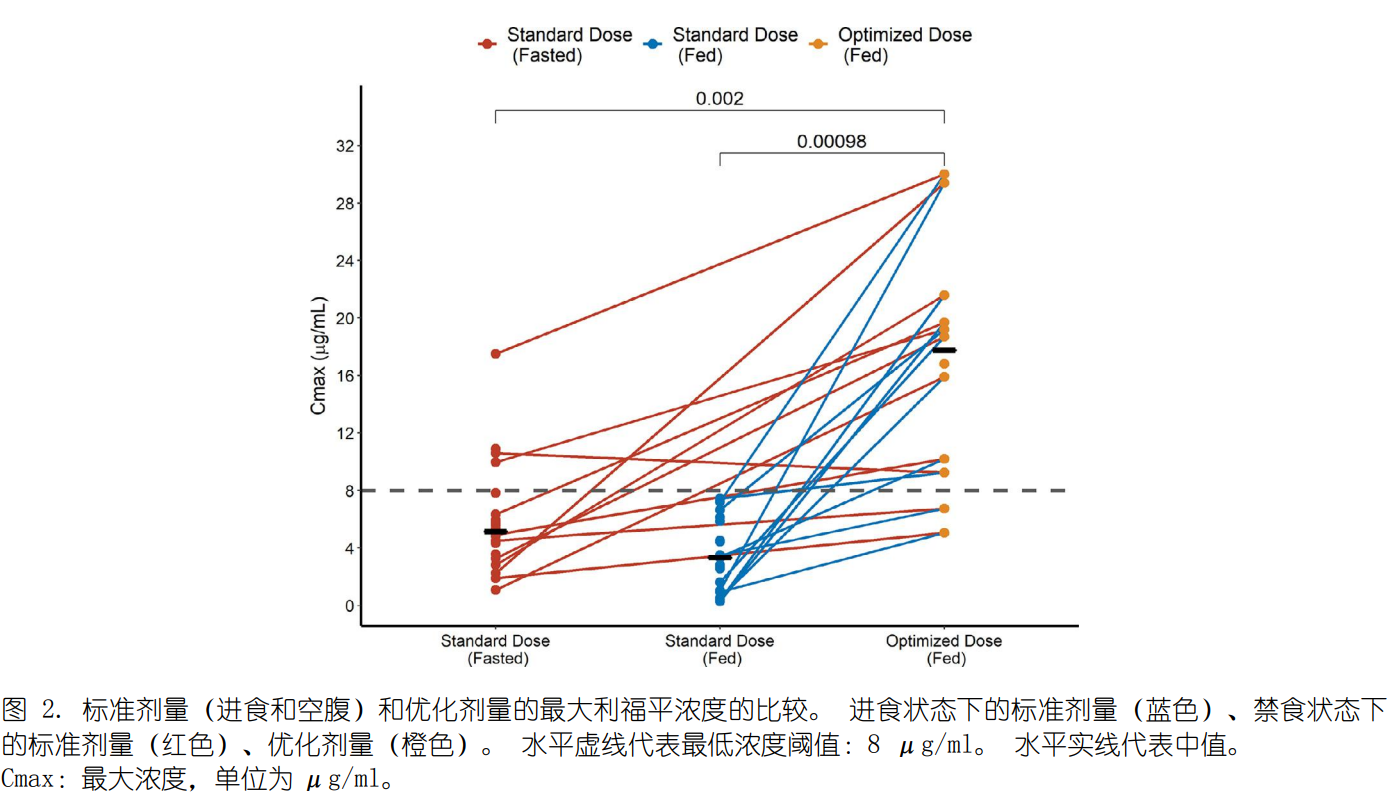
。中位Cmax从标准剂量的2.4 μg/ml 增加至优化剂量的17.8 μg/ml��
,优化剂量相对于标准剂量的几何平均 Cmax为8.29 (90% CI 3.88-17.74��;图2)�
。